1、遺傳毒性雜質的來源及分類
遺傳毒性雜質(Genotoxic Impurities,GTIs)主要來源于藥物的生產過程,如:起始原料、反應物、催化劑、試劑、溶劑、中間體、副產物、降解產物等,包括致突變性雜質和其它類型的無致突變性雜質。根據雜質是否有致癌性和致突變性(如:細菌回復突變試驗是否為陽性、是否含警示結構等),分為5類:
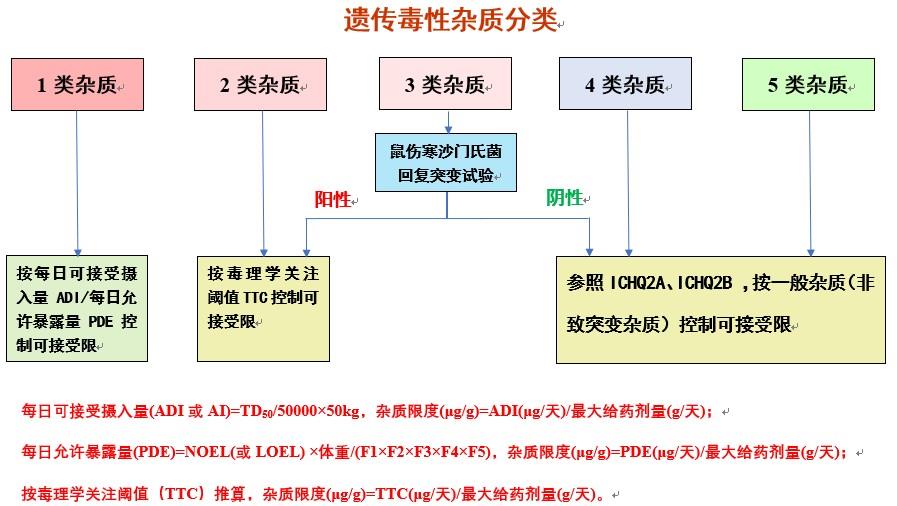
1類:已證明有致突變性和致癌性。
2類:已證明有突變性(細菌致突變試驗陽性),致癌性未知(無嚙齒動物致癌性數據)。
3類:無致突變性數據,有警示結構,該警示結構與原料藥的結構無關。
4類:已證明無致突變性,有警示結構,該警示結構與原料藥或其相關物質的結構有關。
5類:無警示結構,或有足夠的證據證明該警示結構無致突變性或致癌性。
2、業務范圍
根據客戶需求,提供遺傳毒性雜質分析方法開發、驗證及樣品檢測服務(涵蓋起始物料、中間體、原料藥、制劑,如:磺酸酯類、N-亞硝胺類等),并配合客戶進行分析方法轉移。
3、遺傳毒性雜質控制策略
4、相關技術要求
ICH M7(R1): Addendum to
M7: Assessment and Control of DNA Reactive (Mutagenic) Impurities in
Pharmaceuticals to Limit Potential Carcinogenic Risk.(評估和控制藥物中DNA 反應性(致突變)雜質以限制潛在的致癌風險)(征求意見稿)
ICH Q3A(R2): Impurities
in New Drug Substances.(新型原料藥中的雜質問題)。
ICH Q3B(R2): Impurities
in New Drug Products.(新型藥品中的雜質問題)。
《中國藥典2020年版》四部-<遺傳毒性雜質控制指導原則>(第二次征求意見稿)。
